
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Гидролиз солей. Гидролиз – это обменное взаимодействие ионов соли с молекулами воды, в результате которого смещается равновесие электролитической диссоциации воды
|
|
Гидролиз – это обменное взаимодействие ионов соли с молекулами воды, в результате которого смещается равновесие электролитической диссоциации воды
H2O ⇆ H+ + OH-.
Гидролиз происходит лишь в тех случаях, когда ионы, образующиеся в результате электролитической диссоциации соли - катион, анион или оба вместе - способны образовывать с ионами воды малодиссоциирующие соединения, а это, в свою очередь, происходит тогда, когда катион - сильно поляризующий (катион слабого основания), а анион - легко поляризуется (анион слабой кислоты). При этом изменяется рН среды. Если же катион образует сильное основание, а анион - сильную кислоту, то они гидролизу не подвергаются.
Часто возникает необходимость быстрой качественной оценки силы оснований и кислот без использования соответствующих табличных данных (табл. 8.2). Поэтому полезно сформулировать несколько простейших правил, пригодных для растворов обычных (~ 0, 1М) концентраций.
1. Сильными являются основания, образованные щелочными, щелочно-земельными металлами и Tl+, причем их сила возрастает с ростом атомной массы и радиуса катиона. Остальные основания – слабые.
2. Сила оснований уменьшается с увеличением заряда катиона. Таким образом, с учетом правил 1 и 2 основания Ba2+, Sr2+, Ca2+ - довольно сильные, их сила уменьшается в этом ряду; основание Mg(OH)2 - средней силы, а Be(OH)2 - слабое.
3. Сила бескислородных кислот возрастает с уменьшением энергии связи Н-Э и уменьшением отрицательного заряда Эn-.
Таким образом, в ряду HF, HCl, HBr, HI сила кислоты возрастает (HF - слабая кислота, хотя она и весьма активна во многих реакциях, например, растворяет стекло, кварц!); однако, HF все же сильнее, чем H2O, и тем более чем H3N.
4. В случае кислородных кислот общей формулы 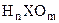 сила кислоты увеличивается с ростом (m - n) в формуле кислоты. Например, в HClO4, HNO3, H3PO4 и H3BO3 величина (m - n) равна 3, 2, 1 и 0, соответственно, поэтому сила кислот в этом ряду резко уменьшается (K1 от 1010 в HClO4 до примерно 10-10 в H3BO3);
сила кислоты увеличивается с ростом (m - n) в формуле кислоты. Например, в HClO4, HNO3, H3PO4 и H3BO3 величина (m - n) равна 3, 2, 1 и 0, соответственно, поэтому сила кислот в этом ряду резко уменьшается (K1 от 1010 в HClO4 до примерно 10-10 в H3BO3);
при одинаковых формулах кислот их сила уменьшается с увеличением радиуса центрального атома Х. Например, H3AsO3 - слабая кислота, H3SbO3 - амфотерное соединение, H3BiO3 – почти не проявляет кислотных свойств, и лучше говорить, что Bi(OH)3 - слабое основание.
1. Гидролиз соли слабого основания и сильной кислоты проходит по катиону, при этом может образоваться слабое основание или основная соль, если катион имеет заряд больше единицы. В этом случае в растворе увеличивается концентрация Н+ и рН раствора уменьшится (среда кислая, рН < 7):
 1-ая ступень: Al3+ + H2O ⇆ Al(OH)2+ + H+;
1-ая ступень: Al3+ + H2O ⇆ Al(OH)2+ + H+; 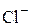 + H2O ⇆.
+ H2O ⇆.
AlCl3 + H2O ⇆ Al(OH)Cl2 + HCl;
основная соль
2-ая ступень: Al(OH)2+ + H2O ⇆ Al(OH)2+ + H+;
Al(OH)Cl2 + H2O ⇆ Al(OH)2Cl + HCl;
3-я ступень: Al(OH)2+ + H2O = ¯ Al(OH)3 + H+;
Al(OH)2Cl + Н2О = ¯ Al(OH)3 + HCl.
Гидролиз данной соли проходит в три ступени, так как заряд катиона равен трем.
2. Гидролиз соли слабой кислоты и сильного основания проходит по аниону, при этом может образоваться слабая кислота или кислая соль (если заряд аниона больше единицы). В результате гидролиза в растворе образуются ОН-. рН раствора увеличивается (среда щелочная, рН > 7):
1-ая ступень: SO32-+ H2O ⇆ HSO3- + 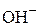 .
.
Na2SO3 + H2O ⇆ NaHSO3 + NaOH;
кислая соль
Гидролиз этой соли протекает в две ступени (т.к. заряд аниона равен двум).
Обычно гидролиз соли, если он происходит по многозарядному иону - катиону или аниону - не идет дальше первой ступени, так как степень гидролиза по второй ступени значительно меньше, чем по первой. Исключением являются соли, образующие трудно растворимые или сильно летучие промежуточные или конечные соединения. Например, в приведенном ниже примере гидролиз трехвалентного катиона идет до второй ступени вследствие образования малорастворимой оксосоли:
Sb3+ + H2O ⇆ SbOH2+ + HCl; SbOH2+ + H2O ⇆ Sb(OH)2 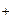 + НСl;
+ НСl;
Sb(OH)2Cl ® SbOCl¯ + H2O. SbCl3 + H2O = SbOCl¯ + 2HCl;
3. Гидролиз соли слабого основания и слабой кислоты обычно проходит нацело с образованием слабой кислоты и слабого основания; рН раствора при этом незначительно отличается от 7 и определяется относительной силой кислоты и основания (рН» 7):
 3H2O
3H2O
 Al2(SO3)3 + 6H2O ® ¯ 2Al(OH)3 + 3H2SO3
Al2(SO3)3 + 6H2O ® ¯ 2Al(OH)3 + 3H2SO3
3SO2 .
Реакция в этом случае идет до конца, так как при гидролизе катиона образуется Н+, при гидролизе аниона - ОН 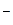 , далее происходит образование из них Н2О (с выделением энергии), что и смещает равновесие гидролиза вправо.
, далее происходит образование из них Н2О (с выделением энергии), что и смещает равновесие гидролиза вправо.
4. Гидролиз соли сильного основания и сильной кислоты не протекает:
 Na2SO4+ H2O ®.
Na2SO4+ H2O ®.
Соли такого типа гидролизу не подвергаются, а растворы практически нейтральны (рН» 7).
Особый случай гидролиза - гидролиз галогенангидридов, тиоангидридов и других подобных ковалентных соединений, когда продуктом гидролиза электроположительного атома является гидроксид кислотного характера (то есть кислота):
SbCl5 + 4H2O ® H3SbO4 + 5HCl;
SiS2 + 3H2O ® H2SiO3 + 2H2S.
В этих случаях гидролиз идет с образованием двух кислот, причем это происходит в молекулярном виде, так как ангидриды в водном растворе не диссоциируют на катион и анион.
Во многих случаях необходимо предотвратить гидролиз. Эта задача решается как обычная задача смещения равновесия: необходимо добавлять в раствор сильную кислоту (при гидролизе по катиону) или щелочь (гидролиз по аниону).
Пример 16. Добавлением каких из приведенных веществ можно уменьшить гидролиз соли Na2CO3: а) НСl, б) NaOH, в) Н2О?
Решение. Запишем ионное уравнение гидролиза: СО32- + НОН ⇆ НСО3- + ОН-.
Поскольку процесс гидролиза является обратимым, то в соответствии с законом действия масс можно сместить равновесие в ту или иную сторону введением в раствор кислоты или основания. В присутствии щелочи концентрация ОН-- ионов возрастает, равновесие смещается влево и гидролиз подавляется. При добавлении кислоты происходит связывание ОН-- и Н+- ионов в воду и равновесие смещается вправо, гидролиз усиливается.
Следовательно, уменьшить гидролиз Na2CO3 можно добавлением NaOH.
Усилить гидролиз - добавлением кислоты или разбавлением раствора (а, в).
Пример 17. Укажите, при гидролизе каких солей 1) KCl, 2) Na3PO4, 3) ZnSO4
а) среда раствора щелочная; б) образуются ионы Н+; в) образуется кислая соль?
Решение: а) Соль KCl образована сильным основанием (КОН) и сильной кислотой (HCl), следовательно, гидролиз не протекает, среда нейтральная (рН» 7);
Соль Na3PO4 образована сильным основанием (NaOH) и слабой кислотой (Н3PO4), следовательно, гидролиз протекает по аниону, основание сильнее кислоты - среде щелочная, рН > 7;
Соль ZnSO4 образована слабым основанием Zn(ОН)2 и сильной кислотой H2SO4. Гидролиз идет по катиону, среда кислая (кислота сильнее основания, рН < 7).
Таким образом: а) ответ 2; б) ответ 3; в) ответ 3.
|
|